蛋白质药物因其高特异性及高活性,近年来在癌症、自身免疫病、血友病、糖尿病等多种重大恶疾的治疗中愈发重要。然而蛋白质药物通常具有较高的免疫原性,容易引发病人免疫应答产生抗药物抗体(anti-drug antibody,简称ADA)。临床数据表明即使是人源化的蛋白质药物也会引起ADA的产生。ADA会使药物失去其效力,甚至引起严重的过敏反应威胁病人生命安全。通过对蛋白质药物进行PEG化修饰能够延长蛋白质的循环时间,并在一定程度上降低免疫原性。近年来动物实验及临床证据均表明,PEG自身具有可观的免疫原性,会诱发机体产生anti-PEG抗体(本质上也可认为是一种ADA),进而造成PEG化药物在血液中加速清除(accelerated blood clearance,简称ABC效应)。因此,寻找新型低免疫原性的抗生物污染高分子用于蛋白质修饰至关重要。
在众多潜在的PEG替代高分子中,非结构性(unstructured)的柔性高分子往往更受人们青睐。比如在长效聚多肽-蛋白质融合药物中,聚多肽的设计往往刻意排除具有明显二级结构的序列使其采取完全无规的构象。然而,这一为人们广泛采用的设计思路实际缺乏严格的实验证据支持。其客观原因在于难以设置合理的对照实验组以严格区分聚合物共价化学组成与构象二者分别的贡献——对于绝大部分高分子,要改变聚合物构象必然需要改变其共价化学组成,反之亦然。
为探讨抗生物污染高分子二级结构在降低蛋白质免疫源性方面的结构-功能关系,进而发展低免疫源性高分子用于蛋白质药物修饰,北京大学化学与分子工程学院吕华研究员课题组将研究对象聚焦于聚氨基酸(也称合成聚多肽)。聚氨基酸是一类可生物降解的合成高分子,侧链易修饰,通常具有较好的生物相容性。更为特殊的是,通过改变单体氨基酸的手性类型可以在不改变侧链化学组成的情况下得到二级结构各异(如螺旋或线团)的聚氨基酸,从而为验证聚合物二级结构效应设置较为理想的对照实验组。他们在前期的研究中已证明含寡聚乙二醇侧链的聚谷氨酸酯(P(EG3Glu))在金基底表面表现出二级结构依赖的抗生物污染能力(Biomaterials,2018,178,728-737),即采取螺旋结构的L-P(EG3Glu)比无二级结构的DL-P(EG3Glu)抗污能力更强。在此基础上,吕华课题组利用以上两种聚氨基酸进一步验证了螺旋结构在降低蛋白质偶联物免疫源性方面的构效关系(图1),相关成果以“Therapeutic Protein PEPylation: The Helix of Nonfouling Synthetic Polypeptides Minimizes Antidrug Antibody Generation”为题,于2019年1月在线发表于美国化学会新旗舰期刊ACS Central Science(DOI:10.1021/acscentsci.8b00548)。
图1.螺旋聚氨基酸比无规卷曲聚氨基酸或PEG在降低蛋白质药物的免疫原性方面效果更为显著
以干扰素(IFN)为模型蛋白,课题组利用自己发展的聚氨基酸与蛋白质N-端特异偶联方法(Biomacromolecules. 2016, 17, 891-896; J. Am. Chem. Soc. 2016, 138, 10995-11000; J. Am. Chem. Soc. 2018, 140, 1170-1178),构建了三种干扰素聚氨基酸偶联物(图2),分别是:修饰了螺旋聚氨基酸L-P(EG3Glu)的L20K-IFN,修饰了无规线团聚氨基酸DL-P(EG3Glu)的DL20K-IFN,以及修饰了传统PEG的PEG20K-IFN(bench maker)。实验结果发现,L20K-IFN在重复给药后引起的免疫反应最为微弱,具体表现在L20K-IFN在体内刺激产生的抗干扰素与抗聚氨基的抗体滴度显著低于DL20K-IFN与PEG20K-IFN两种偶联物在相同实验条件下所产生的抗体(表1)。为了验证该发现的普适性,他们采取相同的合成策略以生长激素(GH)为第二个模型蛋白构建了三种不同的偶联物:L20K-GH、DL20K-GH和PEG20K-GH(图2)。免疫实验结果再一次证实,修饰了螺旋聚氨基酸L-P(EG3Glu)的偶联物在动物体内产生的ADA最少(表1),并且在重复给药时无ABC效应;而修饰了无规卷曲聚氨基酸或PEG的两个对照组偶联物在第三次给药时表现出明显的ABC效应。
图2.携带不同二级结构高分子的蛋白质偶联物的合成
表1.携带不同二级结构高分子的蛋白质偶联物在第四次给药后小鼠血液中的ADA相对滴度
该研究通过设置严格的对照实验组,发现了对蛋白质修饰螺旋聚氨基酸可以抑制ADA的产生,其效果显著优于PEG修饰。这一结果与传统认识大相径庭,启发人们重新审视非结构性高分子用于蛋白质药物修饰的优缺点,并为人们设计新一代低免疫源性蛋白质药物提供了新思路。论文所报道的蛋白质药物的螺旋聚氨基酸化(PEPylation)具有广阔的应用前景和可观的转化潜力。
北京大学化学与分子工程学院2014级博士生侯颖钦为该论文的第一作者,吕华为通讯作者。苏州大学刘庄教授团队为本课题作出贡献。该研究得到国家重点研发计划(2016YFA0201400)、国家自然科学基金(21474004和21722401)支持。基于该技术的国际专利申请获得北京大学科技开发部专利基金资助。
编辑:麦洛
下一篇::量子中心谢心澄教授及合作者在反常量子霍尔效应研究方面取得重要进展
- 物理学院颜学庆卢海洋团队提出激光驱动光子对撞机的新方案
- 物理学院颜学庆马文君团队利用级联加速新机制打破飞秒激光驱动碳离子能量记录
- 分子所刘颖课题组在eLife发文 报道去SUMO化修饰调控线粒体未折叠蛋白质反应及其介导的天然免疫和长寿
- 城环学院刘鸿雁课题组在自然•通讯发文报导极端湿润气候对森林生产力的补偿效应
- 新材料学院潘锋教授团队在Chem. Comm.上发表关于固态锂电池界面工程研发进展的封面文章
- 工学院杨越课题组证实亥姆霍兹涡量定理可推广于非理想流动
我有话说
成人高考
- 湖南成人高考,湖南成人高考报名
- 河北成人高考,河北成人高考报名
- 北京成人高考,北京成人高考报名
- 天津成人高考,天津成人高考报名
- 山西成人高考,山西成人高考报名
- 内蒙古成人高考,内蒙古成人高考报名
- 辽宁成人高考,辽宁成人高考报名
- 吉林成人高考,吉林成人高考报名
- 黑龙江成人高考,黑龙江成人高考报名
- 上海成人高考,上海成人高考报名
- 江苏成人高考,江苏成人高考报名
- 浙江成人高考,浙江成人高考报名
- 安徽成人高考,安徽成人高考报名
- 福建成人高考,福建成人高考报名
- 江西成人高考,江西成人高考报名
- 山东成人高考,山东成人高考报名
- 河南成人高考,河南成人高考报名
- 湖北成人高考,湖北成人高考报名
- 广东成人高考,广东成人高考报名
- 海南成人高考,海南成人高考报名
- 重庆成人高考,重庆成人高考报名
- 四川成人高考,四川成人高考报名
- 贵州成人高考,贵州成人高考报名
- 云南成人高考,云南成人高考报名
- 西藏成人高考,西藏成人高考报名
- 陕西成人高考,陕西成人高考报名
- 甘肃成人高考,甘肃成人高考报名
- 青海成人高考,青海成人高考报名
- 宁夏成人高考,宁夏成人高考报名
- 新疆成人高考,新疆成人高考报名
- 广西成人高考,广西成人高考报名
最新文章
- 1物理学院颜学庆卢海洋团队提
日前,北京大学物理学院颜学庆教授和卢海洋研......
- 2人民医院纪立农团队糖尿病分
日前,国际权威杂志《柳叶刀》糖尿病与内分泌......
- 3物理评论快报报道刘运全教授
原子分子内电子运动的时间尺度约在阿秒(10-......
- 4物理学院颜学庆马文君团队利
日前,北京大学物理学院颜学庆教授/马文君研......
- 5广东省纳米微米材料研究重点
广东省纳米微米材料研究重点实验室近期在国......
推荐文章
热门文章
- 1生命科学学院朱健研究组揭示 Win
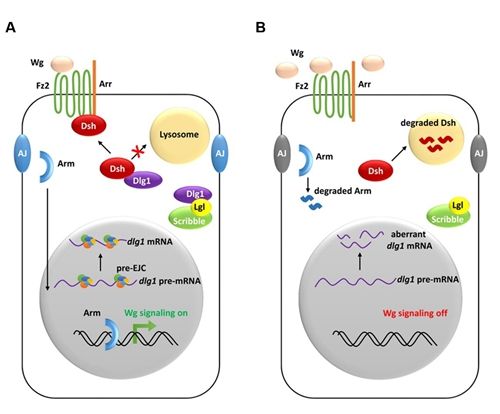
2016年8月18日,eLIfe在线发表了北京大学生命...
- 2北大生命科学学院、生命科学中间
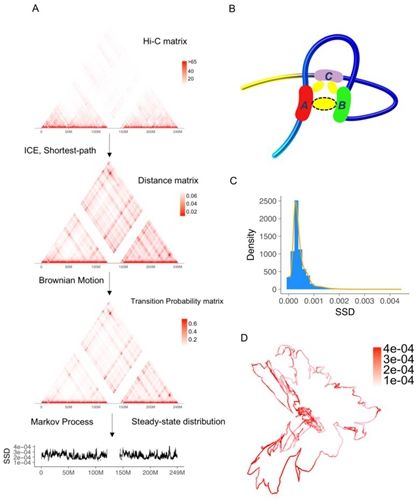
2017年2月9日,北京大学生命科学学院、北大-...
- 3体育馆、专家楼、留学生宿舍楼三

体育馆、专家楼、留学生宿舍楼三项工程于6月...
- 4工学院郭少军课题组与合作者在新
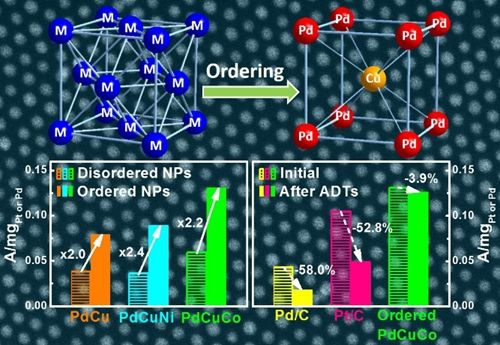
高效氧气电催化剂是实现高性能的燃料电池、...
- 5国际法学院实务教授满运龙发表最

国际法学院实务教授满运龙发表最新著作《美...

